Revue Médecine de la reproduction Trans AMP par le Dr Alix Loiseau
La préservation de la fertilité chez les hommes trans est un enjeu crucial pour que de nombreux individus puissent conserver la possibilité d’avoir des enfants biologiques à l’avenir. De nombreuses associations ou sociétés savantes recommandent une préservation de la fertilité avant de commencer un traitement hormonal ou une chirurgie de réassignation. En 2009, la Haute Autorité de santé recommande de fournir une information sur les effets négatifs des traitements hormonaux sur la fertilité. (1) De même, en 2012, la « World Professional Association for Transgender Health » (WPATH) insiste sur l’importance d’une discussion systématique sur la préservation de la fertilité avant de débuter ces traitements en raison des risques d’altération de la fertilité. (2) En 2018, l’« Endocrine Society » affirme que toutes les personnes recevant un traitement médical de transition doivent être informées et conseillées sur les options de préservation de la fertilité avant le blocage de la puberté chez les adolescents pré-pubères et avant l’hormonothérapie chez les adolescents post-pubères et les adultes. (3)
Avec l’essor de la préservation de la fertilité au cours des deux dernières décennies, l’« European Society for Human Reproduction and Embryology » (ESHRE) a publié des recommandations de bonnes pratiques pour les professionnels impliqués dans ce parcours : informer les patients sur l’impact potentiel des traitements sur la fonction reproductive, les différentes techniques de préservation de la fertilité, les options de réutilisation des gamètes dans le cadre légal du pays et les autres possibilités de parentalité, comme l’adoption.(4)
Mais la réalisation pratique de cette préservation de la fertilité ainsi que l’utilisation des gamètes par la suite les hommes trans en France est un sujet complexe qui combine des aspects médicaux, juridiques et éthiques.
En 2021, une étude révèle que 71,4 % des CECOS offrent la possibilité de préserver la fertilité aux personnes transgenres. Entre mai 2018 et décembre 2020, 581 personnes transgenres ont été accueillies, avec un âge moyen de 22 ans. Parmi elles, 203 étaient des hommes transgenres ayant un âge moyen de 19,5 ans, dont 11 % ont effectivement procédé à la préservation de leur fertilité, contre 66 % des femmes transgenres. Cette différence s’explique notamment par le caractère plus lourd des procédures de préservation pour les hommes transgenres (stimulation hormonale avec effets secondaires possibles, monitoring de la stimulation, ponction ovocytaire et possibles complications per et post opératoires) que pour les femmes transgenres (simple recueil de spermatozoïdes par masturbation). (6)
Les études publiées mettent en évidence des résultats satisfaisants en terme de nombre d’ovocytes matures recueillis après stimulation, comparables à celui de femmes cisgenres congélant leurs ovocytes pour différentes raisons (infertilité, préservation de la fertilité,raison sociétale) ou à celui de femmes cisgenres donneuses d’ovocytes. Cependant plusieurs questions se posent au moment de la réalisation pratique de cette stimulation ovarienne pour congélation ovocytaire. Nous allons revoir ces points plus en détail dans les chapitres suivants.
Quand réaliser la stimulation ovarienne ?
Comme pour la plupart des indications de préservation de la fertilité, la technique de référence pour les hommes transgenres après la puberté est la cryoconservation d’ovocytes matures après stimulation ovarienne.
Face à l’incertitude concernant l’impact de la testostérone sur la capacité de l’ovaire à répondre à la stimulation ovarienne, la qualité ovocytaire, le taux de fécondation, et les effets épigénétiques potentiels à long terme sur la progéniture, il est souvent demandé de réaliser la congélation ovocytaire avant le début du traitement par testostérone.
Néanmoins, il ne semble pas y avoir de différence significative entre les hommes transgenres ayant été préalablement traités par androgènes et ceux ne l’ayant pas été. (7) (8)
Ainsi, si le traitement par testostérone a débuté, il est habituellement conseillé d’interrompre temporairement ce traitement pour, en théorie, optimiser la réponse ovarienne à la stimulation. L’arrêt de la testostérone avant une stimulation ovarienne chez les hommes trans se fait environ 4 à 6 semaines avant le début du traitement. Cela permet aux ovaires de redevenir réactifs aux gonadotrophines. Le retour des menstruations après la prise prolongée de testostérone est évalué entre 3 et 6 mois. Cependant les changements physiques associés à l’arrêt de la testostérone et de la stimulation hormonale peuvent être considérablement dysphoriques et constituer un obstacle à la préservation de fertilité.
Ainsi, les patients peuvent toujours choisir de poursuivre le traitement par la testostérone pendant la stimulation ovarienne, après avoir été informés de l’impact encore peu connu de la testostérone sur la qualité ovocytaire. Un Case report publié en 2021 a démontré une cryoconservation ovocytaire réussie chez un homme transgenre de 20 ans qui suivait un traitement par testostérone intra musculaire 25mg/semaine depuis 18 mois. (9) Deux autres cas de préservation de la fertilité sans arrêt de la testostérone chez des hommes transgenres ont été rapportés, avec des doses de testostérone par voie sous cutanée à 80mg/semaine. (10) Dans ce case report publié en 2022, l’utilisation de létrozole en parallèle des injections de gonadotrophines était associée à une diminution significative des taux maximaux d’estradiol sans aucun impact négatif sur le nombre d’ovocytes matures collectés et pourrait limiter les symptômes induisant une dysphorie, y compris les saignements de sevrage post-traitement.
Il est intéressant de noter que des études évaluant les changements histologiques ovariens après une exposition à la testostérone chez des hommes trans ont rapporté un effet ovarien entrainant un phénotype similaire au syndrome des ovaires micropolykystiques avec une augmentation du compte des follicules antraux et une collagénisation accrue de la tunique albuginée, une hyperplasie stromale et une lutéinisation des cellules stromales.(11) (12) (13). Ces patients seraient donc plus à risque de syndrome d’hyperstimulation ovarienne.
Aucune étude animale pertinente ne rapporte de cas de grossesses après utilisation des ovocytes exposés aux androgènes sans arrêt de la testostérone pendant la stimulation ovarienne, et l’impact à long terme de l’exposition à la testostérone sur les résultats en matière de reproduction est largement spéculatif. Cependant une étude de Lierman et al (14) de 2017 a évalué la compétence développementale des ovocytes exposés à la testostérone chez les hommes transgenres. Dans cette étude portant sur 16 hommes transgenres, les auteurs ont constaté que l’analyse de la structure du fuseau, un marqueur qualitatif de la fonctionnalité des ovocytes, et l’alignement chromosomique après vitrification semblaient normaux.
Dans une étude transversale portant sur 41 hommes transgenres, 5 ont eu une grossesse après leur transition hormonale alors qu’ils étaient en aménorrhée sous testostérone. Bien que la durée du traitement par la testostérone n’ait pas été décrite pour ces 5 individus, les données de cette étude soutiennent que les hommes transgenres sous testostérone peuvent conserver leur fertilité et obtenir une grossesse. (15)
Quelle stimulation ovarienne réaliser ?
La cryoconservation d’ovocytes matures nécessite au préalable une stimulation ovarienne par gonadotrophines (FSH +/-LH) pour stimuler la croissance folliculaire et un blocage de l’axe gonadotrope pour éviter une ovulation prématurée avant la ponction. Les protocoles de stimulation sont similaires à ceux utilisés pour la fécondation in vitro ou pour la préservation de la fertilité chez les femmes. La durée de la stimulation varie entre 10 et 15 jours environ, avec un monitorage régulier par échographies par voie vaginale (si le patient l’accepte, sinon par voie sus pubienne) et prélèvements hormonaux. Lorsque les critères de déclenchement sont atteints, une injection d’hCG recombinante et/ou d’agoniste de la GnRH est réalisée et la ponction est programmée 36 h après celle-ci. Le prélèvement ovocytaire est réalisé par ponction transvaginale échoguidée, sous anesthésie locale ou générale. Les ovocytes matures recueillis sont congelés par la technique de vitrification, puis conservés dans l’azote liquide jusqu’à leur utilisation qui impliquera l’utilisation de procédés de FIV.
Les Protocoles de stimulation ovarienne (cf schémas)
Les protocoles conventionnels antagonistes ou agonistes peuvent en théorie être tous les deux proposés.
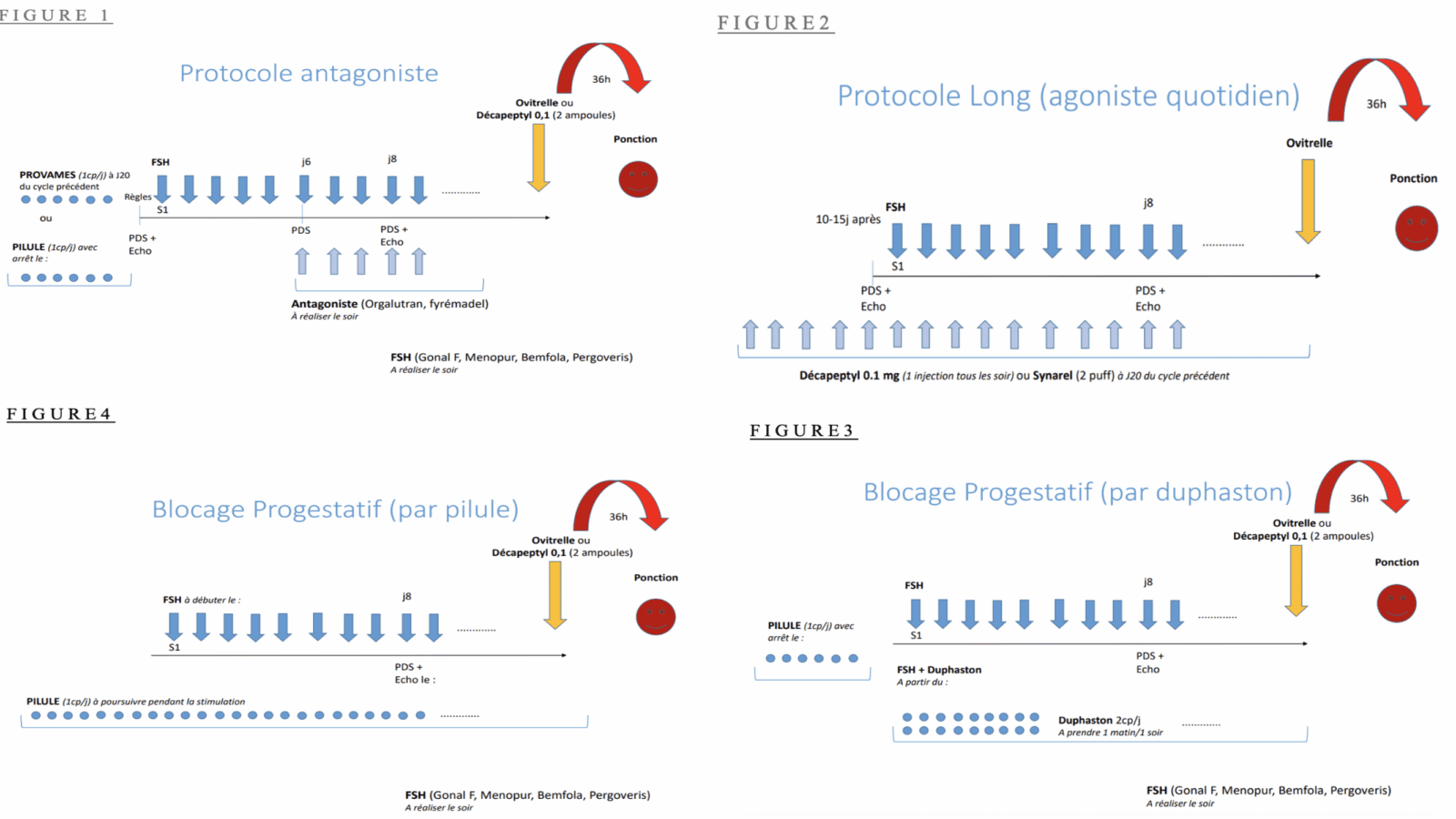
1. Protocole antagoniste (FIGURE 1) : stimulation ovarienne par gonadotrophines en début de phase folliculaire (avec ou sans pré traitement par provames ou pilule), ajout d’un antagoniste de la GnRH à partir du 6eme jour de la stimulation, déclenchement par agoniste de la GnRh possible et à privilégier pour réduire le risque de syndrome d’hyperstimulation ovarienne, sinon par hCG recombinante.
2. Protocole agoniste (FIGURE 2) : blocage de l’axe hypothalamo hypophysaire par agoniste de la GnRH à débuter soit le 1er jour du cycle soit en phase lutéale du cycle précédent, puis stimulation ovarienne par gonadotrophines 10-15 jours plus tard, déclenchement possible uniquement par hCG recombinante avec risque accru d’hyperstimulation ovarienne en cas de réponse ovarienne importante. En pratique, les protocoles antagonistes, qui permettent le déclenchement de l’ovulation par agoniste de la GnRH, doivent être privilégiés pour réduire le risque de syndrome d’hyperstimulation ovarienne.
Un autre protocole a été développé récemment et permet également un déclenchement de l’ovulation par agoniste de la GnRH. Il s’agit du protocole PPOS (progestin priming ovarian stimulation) qui semble particulièrement intéressant dans la population des hommes trans. Dans ce protocole on utilise de la progestérone ou un progestatif pour bloquer l’axe gonadotrope à la place de l’analogue de la GnRH (agoniste ou antagoniste).
Ce protocole permet donc de limiter le nombre d’injections (progestatif pris par voie orale, contrairement aux analogues de la GnRH qui se présentent sous forme d’injections sous-cutanées) et présente l’avantage d’être associé à un faible coût. La progestérone agit sur la pulsatilité de la GnRH, inhibant la libération de LH associée à l’augmentation des taux d’œstradiol.
Le blocage progestatif peut se faire soit par dydrogesterone (FIGURE 3) à débuter en même temps que les injections de gonadotrophines, soit par progestatifs (FIGURE 4) à débuter en amont de la stimulation ovarienne, et se poursuit jusqu’au jour du déclenchement. De nombreux patients transgenres étant déjà sous pilule progestative à visée d’aménorrhée thérapeutique, peuvent donc démarrer une stimulation ovarienne sans arrêter leur pilule, ce qui donne un avantage supplémentaire au protocole PPOS.
Une méta-analyse d’essais contrôlés randomisés datant de 2021 a confirmé que le protocole PPOS était associé à des taux de grossesses cliniques et de naissances vivantes comparables aux protocoles conventionnels. (16) L’utilisation d’un protocole PPOS pourrait également, en soi, significativement diminuer le risque de syndrome d’hyperstimulation ovarienne. (17)
Ainsi en pratique, dans notre centre nous proposons actuellement aux hommes trans qui souhaitent réaliser une préservation de fertilité de débuter un traitement par desogestrel en continu (soit directement soit en relai 1 semaine avant l’arrêt de la testostérone pour conserver une aménorrhée), puis de réaliser la stimulation ovarienne sous desogestrel qui est ensuite poursuivi après la ponction.
Quelle gonadotrophine, à quelle dose?
La dose initiale de gonadotrophine choisie dépend de la réserve ovarienne du patient, estimée grâce au bilan hormonal au 3e jour du cycle, combinée à l’échographie pelvienne avec compte des follicules antraux.
Comme évoqué précédemment, les hommes trans ayant déjà débuté la testostérone ont parfois un phénotype similaire au syndrome des ovaires micropolykystiques avec une augmentation du compte des follicules antraux. Ces patients seraient donc plus à risque de syndrome d’hyperstimulation ovarienne et la dose de gonadotrophine initiale devra donc être adaptée en fonction.
Certaines études ont aussi montré une prévalence plus importante de SOPK chez les hommes trans, même sans traitement par testostérone (18) et une attention particulière doit donc être portée à l’évaluation de l’aspect des ovaires à l’échographie et/ou par le dosage de l’AMH qui a désormais la même valeur que l’échographie pour le diagnostic des ovaires multi folliculaires (19).
Aucune gonadotrophine ne doit être préférée à une autre pour la stimulation ovarienne comme pour toutes les stimulations de préservation de fertilité (4). En effet aucune n’a montré sa supériorité par rapport à une autre. Cependant, en cas de blocage gonadotrope prolongé par les traitements hormonaux donnés aux hommes trans (la pilule oestro-progestative, progestative, ou d’une façon moins importante, la testostérone par exemple), ceux-ci peuvent présenter un déficit plus ou moins relatif en LH pendant la stimulation ovarienne qui peut nécessiter un apport exogène de LH. Il conviendra donc de porter une attention particulière en cas de blocage gonadotrope important en début de stimulation ou de stagnation de la croissance folliculaire et des taux d’œstradiol en cours de stimulation.
Quels freins à la stimulation ovarienne pour préservation de fertilité chez les hommes trans ?
L’incitation à retarder le début de l’hormonothérapie ou à l’interrompre si celle-ci a déjà débuté, est un frein important à la réalisation d’une stimulation ovarienne chez ces patients. L’arrêt de la testostérone engendre différents effets indésirables (fatigue, diminution de la masse musculaire, voire modification de la voix), ce qui peut constituer un frein dans la démarche de préservation de la fertilité. L’hyper oestrogénie induite par la stimulation ovarienne, et les manifestations cliniques qu’elle engendre, ainsi que la réapparition de règles peuvent également être vécues difficilement chez ces patients . Néanmoins, la durée de stimulation reste limitée (12 à 15 jours environ) et ses effets sont transitoires.
Le monitorage de la stimulation ovarienne nécessite des échographies endo vaginales itératives, ce qui peut être mal vécu. Dans ce cas, il est possible de réaliser les échographies par voie sus pubienne si le patient le demande. En cas d’impossibilité de visualiser les ovaires par voie sus pubienne, on peut proposer au patient deréaliser une échographie endo vaginale sous MEOPA (Mélange Equimolaire Oxygène Protoxyde d’Azote), pour un meilleur vécu. La ponction ovocytaire écho guidée par voie vaginale est réalisée sous anesthésie générale ou anesthésie locale selon le choix du patient.
Enfin, les patients sont prévenus des risques encourus lors de la préservation de la fertilité. Il existe un risque d’allergie médicamenteuse, d’hyperstimulation ovarienne, de torsion d’annexe, de thrombose artério veineuse, lors de la stimulation ovarienne. La ponction ovocytaire est un geste chirurgical qui n’est pas sans risque non plus : risque infectieux, risque de plaie d’organe de voisinage (digestif, urinaire) ou vasculaire, risque d’hémopéritoine avec coelioscopie ou laparotomie en urgence.
C’est pourquoi un soutien psychologique par une équipe multidisciplinaire tout au long du processus est fortement conseillé, pour évaluer et gérer l’impact émotionnel et physique de la procédure, ainsi que les effets potentiels de l’arrêt de la testostérone. Un travail d’accompagnement psychologique en amont permettrait d’anticiper ces difficultés et permettrait d’augmenter le pourcentage d’hommes transgenres allant au bout de la démarche.
Perspectives de réutilisation des ovocytes vitrifiés en France
Les ovocytes matures peuvent être mis en fécondation afin d’obtenir des embryons, mais leur utilisation ne pourra se faire que si l’homme transgenre n’a pas changé d’état civil (toujours déclaré femme à l’état civil) et n’a pas subi d’hysterectomie. Cette technique est cependant conditionnée à la disponibilité de spermatozoïdes. L’homme transgenre peut être :
– En couple avec un homme cisgenre (H) : grossesse portée par l’homme transgenre après fécondation de ses propres ovocytes par les spermatozoïdes de son compagnon.
– En couple avec une femme cisgenre (F) ou un homme transgenre (FtM) : grossesse portée par l’homme transgenre après fécondation de ses propres ovocytes avec les spermatozoïdes d’un donneur.
– En couple avec une femme transgenre (MtF) n’ayant pas changé d’état civil (H) : grossesse portée par l’homme transgenre avec les spermatozoïdes de sa compagne.
– Célibataire : grossesse portée par l’homme transgenre après fécondation de ses propres ovocytes avec les spermatozoïdes d’un donneur.
Si l’homme transgenre a changé d’état civil (H), il existe aujourd’hui un flou juridique concernant la potentielle réutilisation de ses gamètes.De plus, la loi actuelle ne permet pas le transfert d’un embryon issu d’un ovocyte d’une personne différente de celle qui porte la grossesse en dehors du don d’ovocytes (« ROPA – reception of oocytes partner »)
Deux études rassurantes rapportent les résultats d’hommes transgenres ayant réalisé une cryoconservation ovocytaire après un arrêt temporaire de la testostérone. Notamment 3 hommes transgenres ont eu une grossesse après fécondation de leurs ovocytes par sperme de donneur ou du conjoint (20). Leung et coll. (21) ont rapporté les résultats chez 7 hommes transgenres ayant accouché d’enfants en bonne santé. Bien que de petite taille et de nature rétrospective, ces deux études suggèrent que le développement folliculaire et la qualité des ovocytes ne semblent pas être significativement affectés par l’utilisation antérieure de testostérone.
Conclusion
La préservation de la fertilité chez les hommes transgenres est en augmentation en France mais il subsiste encore de nombreux freins à la réalisation de ces techniques, liés aux contraintes et à la lourdeur de la procédure de stimulation ovarienne et de ponction ovocytaire. Une prise en charge multidisciplinaire par une équipe spécialisée habituée à recevoir ces patients et un accompagnement psychologique sont indispensables pour que la préservation se passe dans les meilleures conditions. Le protocole de stimulation ovarienne le plus adapté pour les hommes transgenres semble être le protocole PPOS qui permet de limiter le nombre d’injections et présente l’avantage de diminuer significativement le risque de syndrome d’hyperstimulation ovarienne, avec des taux de grossesses cliniques et de naissances vivantes comparables aux protocoles conventionnels. A l’avenir, il conviendra de surveiller les résultats obtenus chez les patients qui réutiliseront leurs ovocytes congelés, le principal obstacle étant l’encadrement juridique strict actuellement en France.
References
(1) Haute Autorité de santé Situation actuelle et perspectives d’évolution de la prise en charge médicale du transsexualisme en France (2009) (2) https://www.wpath.org/publications/soc (3) T’Sjoen G, Arcelus J, Gooren L, Klink DT, Tangpricha V. Endocrinology of Transgender Medicine. Endocr Rev. 2019 Feb 1;40(1):97-117 (4) ESHRE Guideline Group on Female Fertility Preservation; Anderson RA, Amant F, Braat D, D’Angelo A, Chuva de Sousa Lopes SM, Demeestere I, Dwek S, Frith L, Lambertini M, Maslin C, Moura-Ramos M, Nogueira D, Rodriguez-Wallberg K, Vermeulen N. ESHRE guideline: female fertility preservation. Hum Reprod Open. 2020 Nov 14;2020(4) (5) Légifrance – Publications officielles – Journal officiel – JORF n° 0178 du 03/08/2021 (legifrance.gouv.fr) (6) Eustache F, Drouineaud V, Mendes N, Delépine B, Dupont C, Mirallié S, et al. Fertility preservation and sperm donation in transgender individuals: The current situation within the French CECOS network. Andrology. nov 2021;9(6):1790 8. (7) Adeleye AJ, Cedars MI, Smith J, Mok-Lin E. Ovarian stimulation for fertility preservation or family building in a cohort of transgender men. J Assist Reprod Genet. 2019 Oct;36(10):2155-2161. (8) Amir H, Yaish I, Samara N, Hasson J, Groutz A, Azem F. Ovarian stimulation outcomes among transgender men compared with fertile cisgender women. J Assist Reprod Genet. 2020 Oct;37(10):2463-2472 (9) Gale J, Magee B, Forsyth-Greig A, Visram H, Jackson A. Oocyte cryopreservation in a transgender man on long-term testosterone therapy: a case report. F S Rep. 2021 Feb 20;2(2):249-251 (10) Stark BA, Mok-Lin E. Fertility preservation in transgender men without discontinuation of testosterone. F S Rep. 2022 Feb 9;3(2):153-156 (11) Ikeda K, Baba T, Noguchi H, Nagasawa K, Endo T, Kiya T, Saito T. Excessive androgen exposure in female-to-male transsexual persons of reproductive age induces hyperplasia of the ovarian cortex and stroma but not polycystic ovary morphology. Hum Reprod. 2013 Feb;28(2):453-61 (12) Futterweit W, Deligdisch L. Histopathological effects of exogenously administered testosterone in 19 female to male transsexualsJ Clin Endocrinol Metab, 1986 Jan;62(1):16-21 (13) Chadha S, Pache TD, Huikeshoven JM, Brinkmann AO, van der Kwast TH. Androgen receptor expression in human ovarian and uterine tissue of long-term androgen-treated transsexual women. Hum Pathol. 1994 Nov;25(11):1198-204. (14) Lierman S, Tilleman K, Braeckmans K, Peynshaert K, Weyers S, T’Sjoen G, De Sutter P. Fertility preservation for trans men: frozen-thawed in vitro matured oocytes collected at the time of ovarian tissue processing exhibit normal meiotic spindles. J Assist Reprod Genet. 2017 Nov;34(11):1449-1456. (15) Light AD, Obedin-Maliver J, Sevelius JM, Kerns JL. Hommes transgenres ayant vécu une grossesse après une transition de genre femme-homme. Obstet Gynecol. 2014 déc.;124(6):1120-1127. (16) Guan S, Feng Y, Huang Y, Huang J. Protocole de stimulation ovarienne à la progestérone pour les patientes en procréation médicalement assistée : une méta-analyse d’essais contrôlés randomisés. Front Endocrinol (Lausanne). 31 août 2021;12:702558. (17) Eftekhar M, Hoseini M, Saeed L. Stimulation ovarienne à la progestérone dans le syndrome des ovaires polykystiques : un ECR. Int J Reprod Biomed. sept. 2019;17(9):671 6. (18) Baba T, Endo T, Honnma H, Kitajima Y, Hayashi T, Ikeda H, Masumori N, Kamiya H, Moriwaka O, Saito T. Association entre le syndrome des ovaires polykystiques et la transsexualité femme-homme. Hum Reprod. 2007 avr.;22(4):1011-6. doi: 10.1093/humrep/del474. Epub 2006 13 déc. (19) Teede HJ, Tay CT, Laven J, Dokras A, Moran LJ, Piltonen TT, Costello MF, Boivin J, Redman LM, Boyle JA, Norman RJ, Mousa A, Joham AE; Réseau international du SOPK. Recommandations issues des lignes directrices internationales fondées sur des données probantes de 2023 pour l’évaluation et la prise en charge du syndrome des ovaires polykystiques†. Hum Reprod. 5 sept. 2023 ; 38(9) : 1655-1679 (20) Adeleye AJ, Cedars MI, Smith J, Mok-Lin E. Stimulation ovarienne pour la préservation de la fertilité ou la construction familiale dans une cohorte d’hommes transgenres. J Assist Reprod Genet. Oct. 2019 ; 36(10) : 2155-2161 (21) Leung A, Sakkas D, Pang S, Thornton K, Resetkova N. Résultats des techniques de procréation médicalement assistée chez les patientes transgenres (féminines vers hommes) comparées aux patientes cisgenres : une nouvelle frontière en médecine reproductive. Fertil Steril. Nov. 2019 ; 112(5) : 858-865
Article supervisé par Peigné.M, MCU-PH, Hôpital Jean Verdier